৪.৭ redox বিক্রিয়া, কোষ বিভব ও প্রমাণ কোষ বিভব
CuSO4দ্রবণে 5.36 A কারেন্ট 1 ঘণ্টা চালনা → ক্যাথোডে Cu সঞ্চিত হয় 6.35g
MgSO4দ্রবণে 5.36 A কারেন্ট 1 ঘণ্টা চালনা →
EMg2+ /Mg = - 2.36V. ECu/Cu2+ = –0.34V
উপরের উদ্দীপক অনুসারে
Mg এর তড়িৎ রাসায়নিক তুল্যাংক 1.26×10-4
Mg এর পাত্রে CuSO4 দ্রবণ রাখা যায় না
এ কোষে Cu হবে অ্যানোড
কোনটি সঠিক?
i) Mg এর তড়িৎ রাসায়নিক তুল্যাংক 1.26×10-4:
তড়িৎ রাসায়নিক তুল্যাংক (z) হলো একটি মৌল বা যৌগের প্রতি মোল ইলেকট্রনের জন্য প্রয়োজনীয় তড়িৎ পরিমাণ।
Faraday's Law ব্যবহার করে তড়িৎ রাসায়নিক তুল্যাংক নির্ণয় করা যায়:
z = (Q / nF)
যেখানে:
Q = চার্জ (কুলম্ব)
n = মোল ইলেকট্রন
F = (96485 C/mol)
উপরের তথ্য ব্যবহার করে, আমরা Mg এর তড়িৎ রাসায়নিক তুল্যাংক নির্ণয় করতে পারি:
z(Mg) = (5.36 A 3600 s) / (1 mol 2 e⁻ * 96485 C/mol)
= 1.26 × 10⁻⁴
ii) Mg এর পাত্রে CuSO4 দ্রবণ রাখা যায় না:
CuSO4 দ্রবণে, Cu2+ আয়নগুলি ইলেকট্রন গ্রহণ করে এবং Cu ধাতুতে পরিণত হয় (বিজারণ)।
Mg ধাতু Cu2+ আয়নের চেয়ে বেশি বিজারক, তাই এটি Cu2+ আয়নগুলিকে বিজারিত করে এবং নিজেই Mg2+ আয়নে পরিণত হয় (জারণ)।
এই প্রক্রিয়াটি নিম্নলিখিত রাসায়নিক সমীকরণ দ্বারা প্রদর্শিত হয়:
Mg + CuSO₄ → MgSO₄ + Cu
এই বিক্রিয়াটি স্বতঃস্ফূর্তভাবে ঘটে কারণ Mg এর প্রমাণ বিজারণ বিভব Cu এর চেয়ে বেশি।
Ai এর মাধ্যমে
১০ লক্ষ+ প্রশ্ন ডাটাবেজ
প্র্যাকটিস এর মাধ্যমে নিজেকে তৈরি করে ফেলো
উত্তর দিবে তোমার বই থেকে ও তোমার মত করে।
সারা দেশের শিক্ষার্থীদের মধ্যে নিজের অবস্থান যাচাই
লঘু এসিড দ্রবণকে Zn বা Cu
ধাতর মধ্যে কোন ধাতুর পাত্রে রাখা সম্ভব ?
প্রমাণ অবস্থায় নিচের কোষটির emf কত?
Sn(s)/Sn2+ (aq) || H+ (aq)/H2(g) (1.0 atm), Pt
এখানে E°Sn2+/Sn = -0.14 V
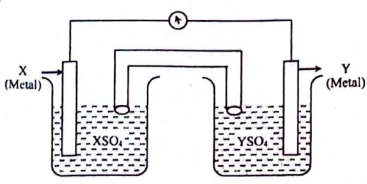
লবণ সেতু-
i. গঠনে তুলা / Agar অর্ধভেদ্য ঝিল্লীর কাজ করে
ii. উভয় তরলের সংযোগ বিভব দূর করে
iii. কোষের জারণ-বিজারণ নিয়ন্ত্রণ করে
নিচের কোনটি সঠিক?